Сяолинь Бай, Цзинъянь Сян,
Цзяншань Дэн, Ван Хай Дин,
Синхуа Луань и Чжи Гэн
Neurology. 2024 Mar 12; Volume 102 Number 5, e209188
У 30-летней женщины через 1 месяц после перенесения COVID-19 возникла быстро прогрессирующая деменция.
Повторный анализ спинномозговой жидкости показал выраженную гипогликорахию, в то время как посевы, метагеномное секвенирование и цитопатологическое тестирование спинномозговой жидкости давали отрицательные результаты. Лабораторные исследования, выполненные в рамках диагностического поиска, выявили повышенный уровень аммиака в крови и CA-125. На МРТ головного мозга было обнаружено двустороннее симметричное диффузное кортикальное поражение. Данные изменения на МРТ имели легкую гиперинтенсивность на Т1-взвешенном изображении и копили контрастное вещество. Более тщательный сбор анамнеза и специальные исследования впоследствии указали на этиологию. Данный клинический случай иллюстрирует подход к диагностике молодого пациента с быстро прогрессирующей деменцией, тяжелой гипогликорахией и диффузными поражениями ЦНС, подчеркивая важность широкого диагностического поиска.
Часть 1
В клинику поступила 30-летняя женщина, у которой в течение предшествующего месяца наблюдались прогрессирующее снижение памяти и афазия Брока. За 1 день до поступления пациентка могла выполнять бухгалтерскую работу самостоятельно. Произошедшие незадолго до поступления в клинику отравления и укусы насекомых, а также отягощенный семейный анамнез пациентка отрицала. Одним месяцем ранее у пациентки был положительный ПЦР-тест на SARS-CoV-2, тогда же пациентка испытывала лихорадку, кашель и усталость. На момент поступления лихорадки у пациентки не было. Общий осмотр выявил гигантские врожденные меланоцитарные невусы (ВМН) на нижних конечностях (рис. 1А). С неврологической точки зрения у нее не было никаких дефицитов, кроме значительной когнитивной дисфункции: по краткой шкале оценки психического статуса (Mini-mental State Examination, MMSE) пациентка набрала 22 балла из 30. У пациентки наблюдались значительные нарушения непосредственной памяти, беглости речи и внимания, но при этом сохранялись способности к пониманию, ориентации и счету. В течение 5 дней состояние пациентки резко ухудшилось: по MMSE пациентка набирала уже 15 баллов из 30, а афазия стала смешанной. МРТ головного мозга показала диффузную гиперинтенсивность на Т1-взвешенном изображении (T1WI) (рис. 1B), повышенную интенсивность в режиме FLAIR (рис. 1C), накопление контрастного вещества (рис. 1D) и отсутствие ограничения диффузии.
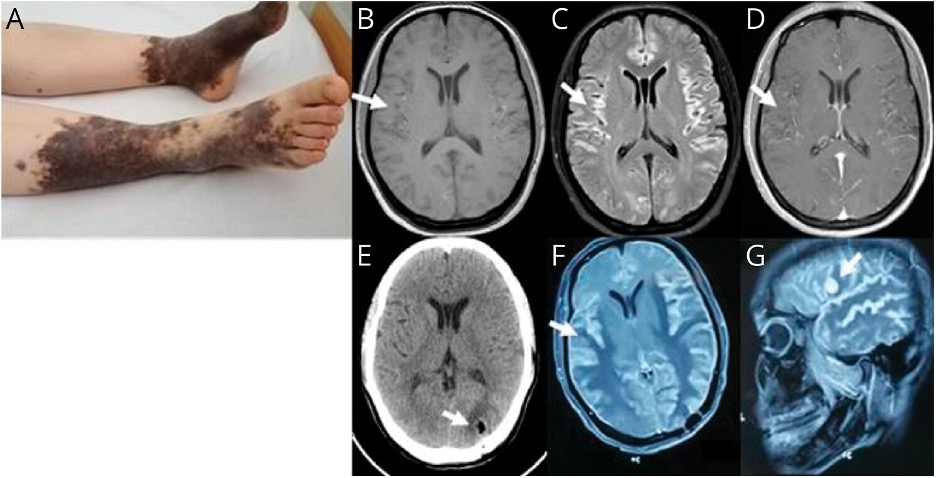
Рисунок 1
(А) Большие врожденные меланоцитарные невусы (ВМН) неправильной формы с множественными сателлитными невусами на нижних конечностях, МРТ выявила слегка диффузную гиперинтенсивность двусторонних полушарий головного мозга на T1WI (B), повышенную интенсивность в режиме FLAIR © и накопление контрастного вещества (D). (Е) Послеоперационная КТ на 2-й день. Повторная МРТ через 6 месяцев выявила продемонстрировала более толстые и распространенные повреждения с отеком (F), а также появление нового очага, накапливающего гадолиний, в левой лобной доле (G).
Вопросы к части 1
- Каков дифференциальный диагноз?
- Какие дальнейшие шаги нужно предпринять в обследовании пациентки?
Часть 2
Дифференциальный диагноз включал воспалительное/аутоиммунное заболевание (что было весьма вероятным, учитывая COVID-19 в анамнезе), инфекционное заболевание (возможность вирусной или бактериальной коинфекций исключать было нельзя), нарушение метаболизма (например, гипогликемическая энцефалопатия), онкологическое заболевание (например, внутричерепные метастазы первичной меланомы кожи), нейродегенеративное заболевание (например, болезнь Крейтцфельдта—Якоба), сосудистые заболевания и отравления (менее вероятны, учитывая скорость развития и отрицание пациенткой вредных воздействий в анамнезе).
Тестирование выявило повышенный уровень аммиака в крови (54 мкмоль/л, норма = 9–30 мкмоль/л) и CA-125 (56,81 Ед/мл, норма = 0–35 Ед/мл). Другие исследования, в том числе оценка функции печени, щитовидной железы, почек, воспалительных и иммунологических показателей, анализы на инфекции (гепатит, сифилис, вирус иммунодефицита человека (ВИЧ) и туберкулез), уровни креатинфосфокиназы, лактатдегидрогеназы, токсикологический скрининг и МР-ангиография/МР-венография головного мозга, продемонстрировали нормальные результаты. Повторный анализ на аммиак, тандемная масс-спектрометрия крови и мочи и КТ брюшной полости исключили метаболические и онкологические причины заболевания, что позволило предположить, что повышенные уровни аммиака и CA-125 могли на самом деле быть физиологическими. На 24-часовом ЭЭГ-мониторинге отмечалась фоновая активность в бета-диапазоне с частой тета-дельта- и спайковой или спайк-медленно-волновой активностью в обоих полушариях, без периодических разрядов и эпилептических приступов. Первоначальный анализ спинномозговой жидкости выявил: начальное давление 80 мм водного столба (норма = 80–180 мм водного столба); лейкоциты 9 × 10^6/л; эритроциты 348 × 10^6/л; белок 0,63 г/л (норма = 0,15–0,45 г/л); глюкоза 0,29 ммоль/л (норма = 2,5–3,3 ммоль/л) при уровне глюкозы в сыворотке 3,9 ммоль/л. Поскольку когнитивные нарушения усугубились, через 5 дней была проведена вторая люмбальная пункция, которая выявила уровень глюкозы 0,28 ммоль/л при уровне глюкозы в сыворотке 7,2 ммоль/л. Повторные посевы спинномозговой жидкости (на вирусы, грибы и микобактерии), ПЦР-тесты на вирус простого герпеса (ВПГ) и SARS-CoV-2, метагеномное секвенирование нового поколения, а также серологический скрининг сыворотки и спинномозговой жидкости на аутоиммунную энцефалопатию и паранеопластические синдромы дали отрицательные результаты.
Вопросы к части 2
- Каков дифференциальный диагноз гипогликорахии?
- Каков дифференциальный диагноз гиперинтенсивных изменений на T1-ВИ МРТ?
- Какие дальнейшие шаги Вы бы предприняли для постановки окончательного диагноза?
Часть 3
Гипогликорахия обычно связана с бактериальным, вирусным (например, ВПГ, ВИЧ и COVID-19), грибковым, туберкулезным и сифилитическим менингитом. Когда тесты на эти причины отрицательны, следует думать о неинфекционной этиологии, главным образом о синдроме дефицита транспортера глюкозы I типа, карциноматозном менингите, субарахноидальном кровоизлиянии и гранулематозном ангиите ЦНС.
На МРТ наше внимание привлекли гиперинтенсивные внутричерепные очаги на Т1-ВИ, которые могли быть обусловлены не таким и большим рядом причин: такой сигнал могли давать метгемоглобин, липиды, белок, минералы и меланин. Первыми вариантами диагноза, с учётом гигантских ВМН, гиперинтенсивного сигнала на T1-ВИ МРТ и выраженной гипогликорахии (соотношение уровней глюкозы в спинномозговой жидкости и сыворотке составляло <0,1), были внутричерепные метастазы меланомы кожи или нейрокожный меланоз.
Для подтверждения онкологической этиологии были проведены исследования циркулирующих опухолевых клеток (ЦОК), цитопатология спинномозговой жидкости и ПЭТ-КТ всего тела с 18F-фтордезоксиглюкозой. Два последних исследования дали отрицательный результат, а анализ на ЦОК выявлил 8 ЦОК. Биопсия кожи ног и левой затылочной доли головного мозга (рис. 1E) не выявила злокачественных новообразований в коже, но показала черную пигментацию в ткани головного мозга (рис. 2А).
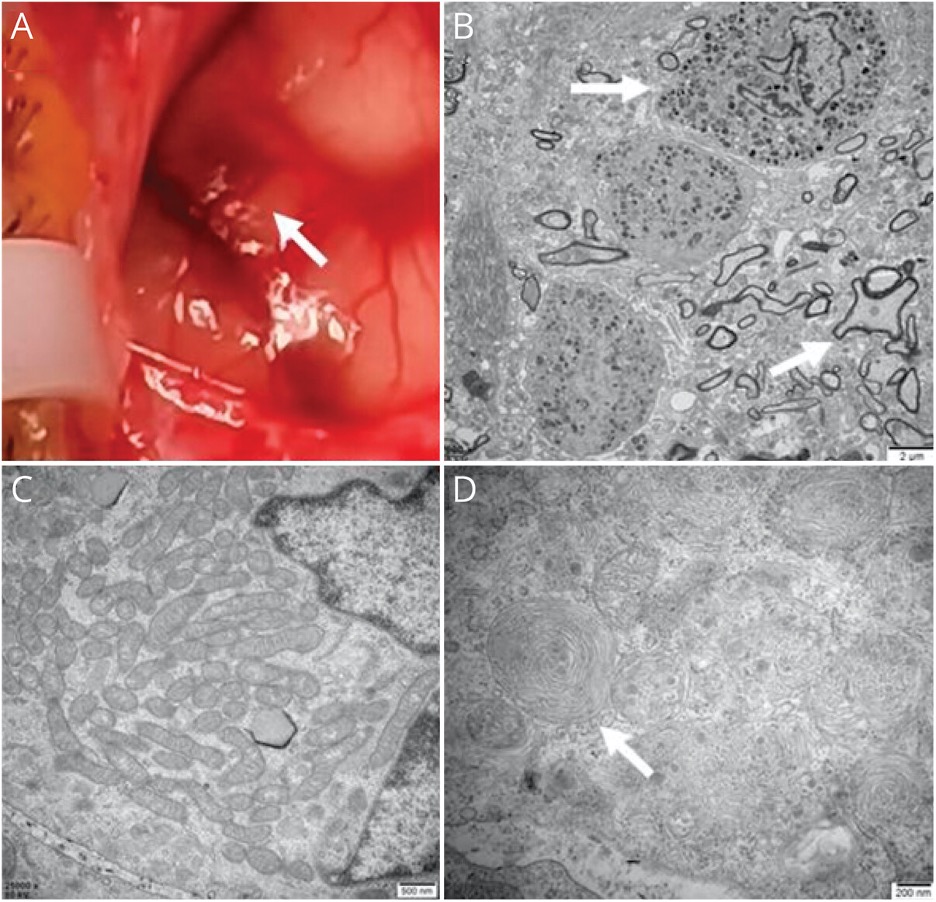
Рисунок 2
(А) Пятнистый меланин (стрелка) на мягкой и паутинной оболочках мозга. (В) Наблюдалось большое количество меланоцитов в ткани головного мозга (стрелка) и аксональная дегенерация с демиелинизацией нервных волокон (стрелка). (D) В нейроне были обнаружены объединенные в кластеры митохондрии © и паттерны, напоминающие отпечатки пальцев (стрелка).
Гистопатологическое исследование показало округлые опухолевые клетки, растущие по субпиальному пространству и частично инфильтрирующие паренхиму головного мозга, равномерно распределенные в виде гнезд с умеренной атипией и отсутствием некроза. Иммуногистохимия показала сильное окрашивание на S100, SOX10, Melan A и HMB45, что говорило о меланоцитарной природе опухоли. Молекулярный анализ меланоцитомы выявил мутацию NRAS Q61K. Электронная микроскопия показала, что меланоциты находились в периваскулярном пространстве с увеличением количества меланосом и митохондрий (рис. 2, B и C). Кроме того, наблюдались аксональная дегенерация, демиелинизация нервных волокон и паттерны, напоминающие отпечатки пальцев (указывающие на лизосомальную дисфункцию, потенциально связанную с декомпенсацией клиренса меланина) (рис. 2, B и D). На основании клинических данных, МРТ, ПЭТ-КТ и биопсии пациентке был поставлен диагноз нейрокожный меланоз (НКМ).
На основании клинических данных, МРТ, ПЭТ-КТ и биопсии женщине поставлен диагноз «нейрокожный меланоз (НКМ)». Диагностическими критериями НКМ являются:
- крупные (>20 см у взрослых, 6–9 см у детей) или множественные (≥3) врожденные меланоцитарные невусы (ВМН) с меланозом или меланомой ЦНС;
- отсутствие меланомы кожи (за исключением пациентов без меланомы головного мозга);
- отсутствие менингеальной меланомы (за исключением пациентов без злокачественных новообразований кожи).
Мы также рассматривали возможность сопутствующей энцефалопатии, связанной с COVID-19, хотя она менее вероятна из-за временной динамики симптомов. Первоначально пациентка получала эмпирическую противоинфекционную и противоэпилептическую терапию. Из-за высокой токсичности, низкой чувствительности опухоли и неспособности выражать страдания химиотерапия и лучевая терапия не применялись. После тщательного обдумывания возможных опций лечения для борьбы с возможной энцефалопатией, ассоциированной с COVID-19, пациентке были назначены пульс-терапия метилпреднизолоном (внутривенно, 1 г/день, в течение 5 дней) и внутривенные иммуноглобулины (0,4 г/кг/день в течение 5 дней). К сожалению, улучшения состояния пациентки не наблюдалось. Ее состояние ухудшилось в течение 6 месяцев; за это время у пациентки развились генерализованные тонико-клонические эпилептические приступы и легочная инфекция. Повторная МРТ продемонстрировала более толстые и распространенные повреждения с отеком (рис. 1F), а также появление нового очага, накапливающего гадолиний, в левой лобной доле (рис. 1G).
Обсуждение
НКМ — это ненаследственный нейрокожный синдром, характеризующийся крупными или множественными врожденными кожными невусами и первичными меланоцитарными опухолями ЦНС, впервые выявленный господином Рокинтанским в 1861 году. Сообщается, что риск НКМ составляет 23% у пациентов с наличием на коже крупных заднесрединных ВМН или множественных сателлитных невусов. Считается, что патогенез НКМ обусловлен аномальной пролиферацией предшественников меланоцитов из нервного гребня, вызванной соматическими миссенс-мутациями, влияющими на путь MAPK, особенно мутациями в генах BRAF и NRAS.
Неврологические симптомы чаще всего возникают у детей, редко у взрослых (в период с 1990 по 2023 годы зарегистрировано всего около 37 случаев НКМ с клиническим дебютом во взрослом возрасте). Примерно 54 % пациентов с симптоматическим НКМ умирают в течение 3 лет после появления симптомов, даже не имея злокачественных новообразований, тогда как пациенты с бессимптомным НКМ имеют обычную продолжительность жизни. Исследования показали, что воспаление, связанное с COVID-19, может создавать микросреду, поддерживающую пролиферацию опухолевых клеток и возникновение генетических мутаций, а также запускающую пробуждение спящих опухолевых клеток. Кроме того, было показано, что SARS-CoV-2 подавляет гены-онкосупрессоры, способствуя онкогенезу. У нашей пациентки неврологические симптомы появились через 1 месяц после заражения COVID-19 и вызванного SARS-CoV-2 повреждения гематоэнцефалического барьера — нейровоспаление могло способствовать развитию НКМ, однако данное предположение о причинно-следственной связи требует дальнейшего изучения. Основными неврологическими симптомами НКМ являются гидроцефалия, симптомы, связанные с внутричерепной гипертензией, а также эпилептические приступы. Поражение спинного мозга встречается примерно у 20% пациентов. При этом быстропрогрессирующая деменция и нормальное внутричерепное давление, наблюдаемые у нашей пациентки, не являются типичными проявлениями НКМ. Результаты анализа спинномозговой жидкости при НКМ обычно включают в себя стерильный лейкоцитоз, высокий уровень белка, повышенное начальное давление и низкий уровень глюкозы, что было подтверждено в ретроспективном исследовании 13 взрослых пациентов с НКМ. Однако крайне выраженная гипогликорахия, наблюдаемая у нашей пациентки, при НКМ встречается крайне редко.
Характерными данными на МРТ являются диффузное лептоменингеальное утолщение в головном и спинном мозге и диффузное линейное контрастное усиление на T1-ВИ. При вовлечении паренхимы головного мозга обычно визуализируются очаги аномального сигнала, особенно в миндалевидном теле, таламусе и лобных долях. МРТ головного мозга нашей пациентки имела уникальные особенности. На МРТ был виден необычный диффузный кортикальный меланоз в обоих полушариях головного мозга, что отличалось от типичной визуализационной картины НКМ. Меланоцитома обычно дает высокую интенсивность сигнала на T1-ВИ и низкую интенсивность сигнала T2-ВИ ввиду парамагнитных свойств меланина, в то время как у нашей пациентки в участках поражения наблюдались высокая интенсивность в режиме T2 FLAIR и сигнал слегка повышенной интенсивности на T1-ВИ, что указывает на возможную малигнизацию с некрозом или же низкое содержание меланина.
В настоящее время не существует единых рекомендаций по лечению НКМ, а варианты лечения включают хирургическое вмешательство, химиотерапию, лучевую терапию, иммунотерапию и симптоматическое лечение. Несмотря на недавние достижения в лечении злокачественной меланомы с помощью иммунотерапии контрольных точек и таргетной терапии, направленной на BRAF и MEK, прогноз НКМ остается неясным.
Данный редкий клинический случай подчеркивает, что НКМ может проявляться быстро прогрессирующей деменцией, а не типичными симптомами, такими как внутричерепная гипертензия, что имеет значительную клиническую ценность при дифференциальной диагностике острой прогрессирующей деменции. Примечательно, что этот случай может подтвердить теорию о том, что COVID-19 способствует реактивации спящих опухолевых клеток. Кроме того, уникальные рентгенологические данные пациентки и крайне выраженная гипогликорахия могут стать дополнительными диагностическими подсказками, указывающими на возможность наличия у пациента НКМ.